توضیحات فراخوان
هدف از انجام این طرح پژوهشی، تولید یک حامل از جنس LNP برای انتقال ماده ژنتیکی به سلولهای خونساز مغز استخوان موش است. در حال حاضر، بهمنظور درمان تالاسمی، از روش برونتنی ژندرمانی استفاده میشود که شامل استخراج سلولهای بنیادی خونی (HSCs)، جدایش سلول، تغییر ژنتیکی و نهایتاً انتقال ماده ژنتیکی به بدن بیمار است.
بهعنوان راهکاری ساده و سریع در این پروژه، حامل به شکل نانوذره هوشمند طراحی خواهد شد که قادر به حرکت از مسیر خون محیطی به سمت مغز استخوان و تحویل اختصاصی ماده ژنتیکی به HSCs است. این حامل میتواند یک سیستم رسانش دارویی با استفاده از LNP کانژوگه شده با آنتیبادی (lipid nanoparticle (LNP) encapsulated- mRNA platform for in vivo delivery) بهمنظور حمل ماده ژنتیکی به سلولهای HSCs در شرایط برونتنی باشد. انتظار میرود با این روش، اصلاح ژنتیکی سلولهای خونی برای بیمار تسریع و تسهیل شود.
پیشینه مسئله پژوهشی
سلولهای بنیادی خونساز HSCs (Hematopoietic Stem Cells) سلولهای اصلی در مغز استخوان هستند که توانایی تولید انواع سلولهای خونی (مانند گلبولهای قرمز، سفید و پلاکتها) را دارند و اگر ژنهای داخل این سلولها دچار اختلال یا جهش (ناهنجاری) شوند، فرایند تولید سلولهای خونی مختل میشود. اختلالات خونی ژنتیکی مانند تالاسمی، کمخونی و حتی سرطان خون از جمله بیماریهایی هستند که منشأ آنها در این ناهنجاریهای ژنی سلولهای بنیادی خونساز (HSCs) نهفته است. تاکنون روشهای درمانی رایج مانند پیوند مغز استخوان از فرد دیگر (HSC آلوژنیک) یا ژندرمانی برونتنی(ex vivo) برای این بیماران مورد استفاده قرار گرفتهاند. با این حال، هر دو روش با چالشهای جدی از جمله کمبودِ دهنده مناسب، رد پیوند، هزینههای بالا، پیچیدگی فرایند و نیاز به بستری طولانیمدت روبهرو هستند.
سلولهای بنیادی هماتوپوئیتیک (HSCs) در مغز استخوان قرار دارند و انواع سلولهای خونی و سیستم ایمنی را از طریق توانایی بازسازی خودشان و تمایز به ردههای میلوئیدی و لنفوئیدی، تولید میکنند. اختلالات هماتوپوئیتیک میتوانند از طریق پیوند HSC آلوژنیک برگرفته از برادر، خواهر، والدین یا یک دهنده غیرخویشاوند، درمان شوند، اما تنها بخش کوچکی از بیماران دارای تطابق ایمنی مناسب برای پیوند هستند. بنابراین، پیوند آلوژنیک همیشه با مشکلاتی مانند رد پیوند (عدم تطابق کامل دهنده و گیرنده) یا نیاز به سرکوب سیستم ایمنی همراه است.
در این میان، ژندرمانی درونتنی (in vivo) بهعنوان یک رویکرد نوین مطرح شده است که میتواند بسیاری از محدودیتهای قبل را برطرف کند. این روش بهجای استخراج و اصلاح سلولها خارج از بدن، تلاش میکند با استفاده از حاملهای هدفمند، اطلاعات ژنتیکی (مثل mRNA) را مستقیماً به سلولهای هدف در بدن بیمار برساند. برای این هدف، طراحی یک پلتفرم رسانش مؤثر، ایمن و هدفمند مانند نانوذرات لیپیدی (LNP) متصلشده به آنتیبادیهای خاص HSCها، راهکاری امیدبخش است. ژندرمانی اتولوگ (مبتنی بر سلولهای خود بیمار) میتواند مشکلات فوق را برطرف کرده و با افزودن یا ویرایش ژن معیوب، اختلالات خونی را بهطور ریشهای درمان کند. درحالیکه روشهای فعلی ژندرمانی برونتنی بهدلیل نیاز به استخراج سلول، انتقال ژن با لنتیویروس یا الکتروپوریشن، تیمار با داروهای شیمیدرمانی و همچنین نیاز به تولید شخصیسازیشده برای هر بیمار، بسیار پرهزینه، پیچیده و محدود به مراکز تخصصی هستند.
برای گسترش این درمان در طیف وسیعتری از بیماران، ارسال مستقیم mRNA به HSCs داخل بدن گزینهای مؤثر و سادهتر خواهد بود و استفاده از سیستم تحویل نانوذرهای لیپیدی غیرویروسی (LNP) متصل به آنتیبادی اختصاصی HSC میتواند ابزاری کارآمد برای این هدف باشد. این روش توانایی هدفگیری دقیق سلولهای بنیادی خونی را دارد و میتواند امکان ویرایش ژنتیکی مستقیم در بدن را فراهم کند، درحالیکه از پیچیدگیهای درمان برونتنی میکاهد.
مشروح مسئله پژوهشی
هدف در این طرح پژوهشی، طراحی و ساخت یک نانوذره لیپیدی (LNP) هدفمند برای HSCs به شرح زیر است:
طراحی و سنتز mRNA اصلاحشده؛ پیوند سلولهای بنیادی خونساز (HSCs) با هدف درمان بیماریهایی مانند تالاسمی و برخی نقصهای ایمنی میتواند با چالشهایی مانند بیماری پیوند علیه میزبان (GVHD) همراه باشد، در روش اتولوگ، ژنوم موردنظر از خود بیمار گرفته شده و پس از اصلاح ژنتیکی دوباره به بدن او بازگردانده میشود که گزینهای مؤثرتر، کمخطرتر و شخصیسازیشده به شمار میآید. در این مرحله لازم است سنتز و تخلیص mRNA به روش IVT (in vitro transcription) صورت گیرد.
طراحی و سنتز mRNA اصلاحشده؛ استفاده از نانوذرات لیپیدی (LNPs) بهعنوان حاملهای غیر ویروسی mRNA راهکاری نوین، ایمن و قابلتوسعه محسوب میشود. برخلاف لیپوزومها یا لیپوپلکسهای رایج، LNPهای مدرن ساختاری پیشرفته و ویژه دارند که نهتنها نیازی به توازن بار الکتریکی برای کارایی ندارند، بلکه بهواسطه استفاده از لیپیدهای قابل یونیزاسیون و ترکیبات PEGylated، از ایمنی و پایداری بالاتری برخوردار هستند. این لیپیدهای قابل یونیزاسیون در شرایط فیزیولوژیک (pH خون) خنثی هستند و در محیط اسیدی اندوزوم بهصورت مثبت شارژ شده و به آزادسازی mRNA درون سلول کمک میکنند. از طرفی، پوشش PEGylated، علاوه بر افزایش پایداری نانوذره، باعث بهبود زمان ماندگاری در خون و جذب سلولی از طریق اندوسیتوز میشود.
فرمولاسیون نانوذره لیپیدی (LNP) که شامل انتخاب ترکیب مناسب از لیپیدهای قابل یونیزاسیون (برای آزادسازی درونسلولی)، لیپیدهای ساختاری (مانند DSPC)، کلسترول (برای پایداری غشایی)، لیپیدهای PEGylated (برای افزایش پایداری در گردش خون)، استفاده از میکروفلوییدیک یا تکنیکهای تزریق سریع برای کپسولهسازی mRNA در LNP است و لازم است ویژگیهای فیزیکوشیمیایی نانوذره مانند اندازه، زتا پتانسیل، درصد کپسولهسازی و پایداری بررسی شوند.
اتصال آنتیبادی هدفمند (CD117) به سطح LNP؛ در این مرحله آنتیبادی منوکلونال ضد CD117 (c-Kit) تهیه شده و پیوند کووالانسی یا استفاده از اتصالدهندههای شیمیایی (مانند Maleimide-PEG یا EDC/NHS) برای الحاق آنتیبادی به سطح LNP ایجاد میشود. سپس میزان و کارایی اتصال آنتیبادی به LNP با استفاده از تکنیکهایی مثل ELISA، DLS، TEM یا فلوسایتومتری ارزیابی میشود.
آزمونهای درون کشتگاهی (in vitro)، انتقال هدفمند mRNA پروتئین GFP به سلولهای بنیادی خونساز (HSC) و آزمونهای درونزندهای (in vivo)؛ که در این پروژه به درون بدن موش منتقل میشود. به این منظور، از آنتیبادی CD117 (نشانگر شناختهشده HSCها) برای هدفگیری اختصاصی استفاده خواهد شد. اتصال آنتیبادی به آنتیژن سطحی CD117 روی HSCها، ورود اختصاصی و مؤثر LNP حاوی mRNA به این سلولها را تسهیل میکند. همچنین، mRNA طراحیشده، بیان پایدار و غیرایمنوژنیک از پروتئین GFP را فراهم میسازد و بهعنوان یک نشانگر مناسب برای بررسی بهعنوان این پلتفرم مورد استفاده قرار میگیرد.
لازم به ذکر است که هدف اصلی این پژوهش، ژندرمانی مبتنی بر سلولهای HSC اتولوگ است.
چالش نیاز فناورانه
با توجه به هدف طرح، طراحی و ساخت یک نانوذره لیپیدی (LNP) هدفمند برای HSCs، در این پژوهش یکی از مراحل کلیدی، سنتز نانوذرات لیپیدی (LNP) و اتصال اختصاصی آنتیبادی CD117 به آنهاست. اگرچه این فرایند نیازمند دقت و دانش فنی بالاست، اما باتوجهبه اینکه تیم فنی شرکت متقاضی سابقه و تجربه قابلتوجهی در زمینه کار با سلولهای بنیادی خونساز (HSCs) و پیوند آنها به مدل حیوانی (موش) دارد، میتوان گفت این بخش از پروژه با چالش جدی روبهرو نخواهد بود.
مهمترین چالشهای این پژوهش در راستای به تولید LNP و اتصال آنتیبادی به آن عبارتاند از:
توانایی جداسازی و شناسایی سلولهای HSC و تشخیص مارکرهای سطحی آنها
دانش و مهارت در کار با حیوانات آزمایشگاهی بهویژه مدل پیوند مغز استخوان در موش
ساخت نانوذرات لیپیدی (LNP) با ویژگیهای مناسب برای انتقال درونسلولی
توانایی کونژوگهسازی یا اتصال mRNA به نانوذرات
اتصال هدفمند آنتیبادی CD117 به سطح LNP
استفاده از نوکلئوزیدهای اصلاحشده برای افزایش پایداری mRNA و جلوگیری از تخریب آن در محیط بدن
با غلبه بر این چالشها، دانش فنی لازم برای تولید سامانه ژندرمانی mRNA-LNP/آنتیبادی CD117 فراهم میشود که در آینده میتواند در مسیر توسعه درمانهای درونتنی بیماریهای خونی استفاده شود.
تیم فنی شرکت متقاضی دارای زیرساختها و تجربیات ارزشمندی است که میتواند اجرای پروژه را تسهیل کند، از جمله:
پلتفرم تخصصی نگهداری و کار با حیوانات آزمایشگاهی
تجربه عملی و گسترده در کار با سلولهای بنیادی خونساز انسانی و موشی
استقرار کامل پروتکلهای جداسازی، تعیین هویت و شناسایی HSCها
مواد مصرفی، آنتیبادیها، و کیتهای تخصصی موردنیاز برای انجام مراحل مختلف پروژه برای کار با HSCs
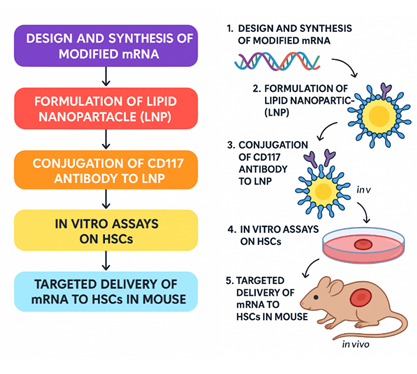
شکل ۱ - شماتیک مراحل اجرایی طراحی و ساخت یک نانوذره لیپیدی (LNP) هدفمند برای HSCs
گامهای پژوهشی
فاز ۱: تولید LNP و انجام کنترل کیفی:
انتخاب و تهیه انواع لیپیدها (شامل لیپید قابل یونیزاسیون، کمک لیپید، کلسترول و لیپید PEGylated)
استفاده از روشهایی مانند microfluidic mixing یا ethanol injection برای سنتز LNP
انجام کنترل کیفی روی پارامترهایی مثل اندازه ذرات (DLS)، بار سطحی (Zeta potential)، پایداری و بازده کپسولهسازی (Encapsulation efficiency)
فاز ۲: اتصال آنتیبادی CD117 به لیپید نانو پارتیکلهای تولید شده
استفاده از روشهای شیمیایی برای اتصال آنتیبادیها به سطح LNP
حفظ فعالیت زیستی و قابلیت شناسایی آنتیژن توسط آنتیبادی
ارزیابی مقدار و صحت اتصال آنتیبادیها به کمک ELISA، SDS-PAGE یا سایر روشهای بیوشیمیایی
فاز ۳: سنتز mRNA ژن GFP و ایجاد mRNA-LNP/Antibody
طراحی پلاسمید حاوی ژن GFP با نواحی UTR مناسب برای افزایش پایداری و ترجمه
ترنسکریپشن با آنزیم T7 و استفاده از نوکلئوتیدهای اصلاحشده برای کاهش ایمونوژنیسیته
بارگذاری mRNA به درون LNP با شرایط بهینه
ارزیابی encapsulation efficiency و پایداری mRNA
فاز ۴: بهینهسازی جداسازی HSCs و تعین هویت آن
استخراج سلولها از مغز استخوان یا بند ناف/خون محیطی (انسان یا موش)
جداسازی با تکنیکهای MACS یا FACS
تعیین هویت HSCs با استفاده از مارکرهای سطحی
تستهای زیستی برای ارزیابی قدرت خودنوسازی یا تمایز (Colony Forming Assays)
فاز ۵: بررسی کارایی پلتفرم ایجاد شده در انتقال به HSCs در محیط برونتنی
تیمار HSCs با دوزهای مختلف و بررسی internalization
سنجش میزان بیان GFP و بررسی سلامت/زندهمانی سلولها پس از تیمار
آنالیز دوز–پاسخ
فاز ۶: تزریق پلتفرم ایجاد شده به مدلهای موشی
انتخاب مسیر تزریق مناسب (IV یا Retro-orbital injection)
تعیین دوز مناسب بر اساس وزن بدن و حجم خون
پایش حیوان از لحاظ ایمنی، سمیت، و پاسخ ایمنی احتمالی
نمونهگیری در بازههای زمانی مختلف پس از تزریق
فاز ۷: جداسازی HSCs موشهای تیمار شده و بررسی بیان GFP در آنها
ارزیابی درصد سلولهای هدف دریافتکننده mRNA و سطح بیان
خروجی پژوهش
خروجیهای مورد انتظار شامل موارد زیر خواهد بود:
دانش فنی طراحی و ساخت یک نانوذره لیپیدی (LNP) هدفمند برای HSCs (در قالب SOP):
میزان سمیت پایین برای HSCs در محیط آزمایشگاه (Invitro) : Viability ≥ 85%
حداقل ۸۵٪ بقای سلولی پس از ۲۴ تا ۴۸ ساعت انکوباسیون با LNP در غلظتهای کاربردی (معمولاً ۰/۱–۱ mg/mL)، بدون نشانههای مرگ سلولی (apoptosis/necrosis) قابلتوجه.
پایداری فرآورده در شرایط تعیین شده در طولانی مدت :
≥ 80% mRNA retention after 3 months at 4°C or -20°C
کارایی ترنسفرم کردن HSCs در مطالعات برونتنی بهاندازه ۵۰درصد
Transfection Efficiency ≥ 50% (GFP+ HSCs by Flow Cytometry)
کارایی ترنسفرم کردن HSCs حداقل بهاندازه ۵درصد در مطالعات درون تنی
Transfection Efficiency ≥ 5% (GFP+ HSCs in bone marrow of mice)
عدم سمیت و آسیب به ارگانهای حیاتی مدل حیوانی در مطالعات درون تنی
Liver enzymes (ALT, AST): در محدوده نرمال )برای موش : ALT < 50 IU/L ،AST < 150 IU/L)
BUN/Creatinine ( کلیه ): BUN < 25 mg/dL ،Creatinine < 0.6 mg/dL
Histopathological score: ≤ 1 (no or minimal inflammation/necrosis in liver, kidney, spleen)
تسهیم مالکیت فکری
مالکیت معنوی: مجری در مالکیت معنوی ناشی از اجرای پژوهش سهیم خواهد بود و انتشار مقاله مشترک توسط مجری و متقاضی در ژورنالهای داخلی و خارجی، ارائه مقاله در کنفرانسها و سمینارها با موافقت و اشاره به نام همه دستاندرکاران مجاز خواهد بود.
مالکیت منافع مادی: با توجه به مدل کسبوکار و اجرا و اثبات دستاوردهای حاصل از طرح توسط شرکت متقاضی، منافع مالی ناشی از توسعه این فناوری برای شرکت متقاضی خواهد شد اما مطابق تراضی بین شرکت متقاضی و مجری، قابل اشتراک بین آنها خواهد بود.
نحوه پذیرش
پذیرش طرحها رقابتی است و از بین پروپوزالهای دریافتی، موردی که شرایط زیر را داشته باشد، در اولویت خواهد بود:
ترکیب متخصصین تیم پیشنهادی مرتبط باشد.
افراد پیشنهادشده، دارای سابقه پژوهشی و فنی در آن موضوع باشند.
زمانبندی، هزینه و شرح خدمات، متناسب و مرتبط با پژوهش مورد تقاضا باشد. (در این بخش، مجری میتواند برآورد اولیه خود را اعلام کند اما بدیهی است جزئیات اجرایی در ابتدای امر مشخص نیست و مجری و کارفرما با علم به این موضوع وارد این توافق خواهند شد.)
تیم پیشنهاددهنده، امکان همکاری با تیم شرکت متقاضی جهت استفاده از زیرساخت سختافزاری و نرمافزاری موجود به منظور پیادهسازی و تست الگوریتمهای ارائه شده را داشته باشند.
پروپوزال، طبق فرمت پیشنهادی بنیاد، تهیه و ارسال شده باشد.
هزینههای قابل قبول
حق التحقیق نیروی انسانی
تست آنالیز توسط متخصص
خدمات
حوزه های اولویتدار
مهندسی برق
مهندسی شیمی
واجدین شرایط
پژوهشگر اصلی تیم لازم است عضو هیئتعلمی فعال یکی از دانشگاهها و مؤسسات آموزش عالی کشور باشد. پس از دریافت پروپوزال از طریق سامانه، ارزیابی انجام گرفته و در صورت کسب امتیاز بالا، تیم برگزیده جهت مذاکره با بنیاد و شرکت متقاضی دعوت خواهد شد.
فایلهای پیوست
فرم درخواست پیشنهاده (پروپوزال)
متن فراخوان
تاریخ فراخوان
کلیه افراد واجد شرایط به مدت یک ماه از تاریخ انتشار فراخوان یعنی تا ۲۸ مرداد فرصت دارند که پروپوزال خود را از طریق سامانه کایپر برای بنیاد ملی علم ایران ارسال نمایند.
شایان ذکر است که مهلت ثبت این پیشنهاده، تاریخ اعلام شده در فراخوان بوده و پیشنهادههایی که پس از این تاریخ ثبت شوند مورد بررسی قرار نخواهند گرفت.
مبلغ حمایت
پژوهش پیشنهاد شده تا سقف ۸۰ درصد، حداکثر ۲/۵ میلیارد تومان، توسط بنیاد ملی علم ایران حمایت خواهد شد. بدیهی است که مابقی هزینهها باید توسط شرکت متقاضی ارائه دهنده پژوهش تأمین شود.
شیوه ثبت نام و ارسال درخواست
متقاضیان گرامی جهت ثبتنام میتوانند به سامانه مدیریت پژوهش کایپر مراجعه و از طریق بخش متقاضیان/ پژوهشگران اقدام نمایند. درصورتیکه در این سامانه پروفایل مشخصات فردی ندارید ابتدا ثبتنام نموده و سپس بهوسیله نام کاربری (Email) و رمز عبور اعطا شده وارد سامانه شوید. پس از ورود در بخش ارسال طرح جدید میتوانید از کارتابل پژوهش عمیق شرکتهای دانشبنیان اقدام به ارسال طرح نمایید.
مسئول پاسخگویی
در صورت داشتن هرگونه سؤال میتوانید با کارگروه دانشبنیان با ایمیل hatamkhani.a@insf.org و شماره تلفن ۰۲۱۸۲۱۶۱۱۵۰ تماس بگیرید.

